-

-
 0371-88917869
0371-88917869 -


-







至此,由河南省医学科学院肿瘤研究所副所长、河南省肿瘤医院内科副主任王启鸣教授牵头自主研发的以Trop2为靶点的接头蛋白偶联CAR-NK(嵌合抗原受体-自然杀伤细胞)疗法,作为河南省首个获批开展临床研究的I类细胞药物,正式启动临床试验,填补省内空白。
同时,这也是全球首个针对肺癌患者运用以Trop2为靶点的接头蛋白偶联CAR-NK疗法开启的临床应用案例。
近年来,癌症免疫治疗领域中,CAR-T、TCR-T、TIL疗法一直是炙手可热的抗癌选手。
其中CAR-T细胞疗法,作为其中的佼佼者,更是迅速成为抗癌领域的“新晋明星”,在治疗血液肿瘤方面取得了突破性的进展。
但由于靶点的局限性,限制了CAR-T疗法在实体瘤领域的应用;而动辄百万的价格,更让众多患者望而却步。
近年来,NK细胞与CAR工程技术结合衍生出的CAR-NK细胞疗法,在早期临床试验中展现出惊艳的效果,有望填补CAR-T在治疗实体瘤方面的缺憾,剑指肺癌、胰腺癌等多种实体瘤,整个治疗过程和普通输液一样简单。
未经改造的人体内的NK细胞在体内巡逻,碰见了肿瘤细胞,识别后,才能杀伤肿瘤细胞。大部分情况下,NK细胞碰不到肿瘤细胞,即使碰见了也不一定能识别杀伤肿瘤细胞。
王启鸣教授介绍,由该团队研制的以Trop2为靶点的接头蛋白偶联CAR-NK细胞,是把体外培养的NK细胞,装到车上(CAR),相当于给这辆车装载了国产的、自主研发的“导航系统”——肿瘤细胞表达Trop2,而这辆车可以拉着NK细胞锁定并送到肿瘤细胞身旁,使NK细胞更精准的、近距离杀伤肿瘤细胞。
既保留NK细胞原有抗癌战斗力,又能实现精准打击,使癌细胞“无所遁形”。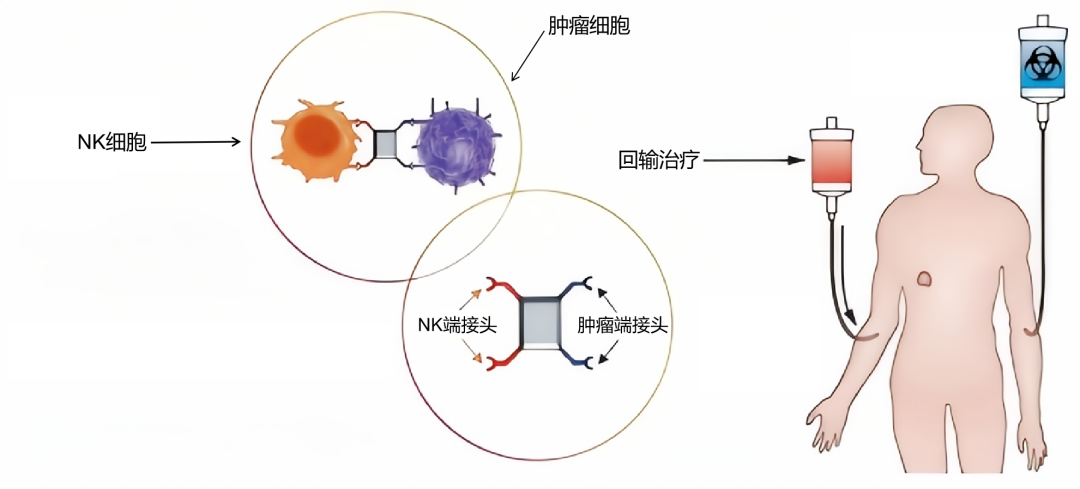
在本项目中,研发团队利用自然杀伤细胞上天然存在的多个表位,将CAR结构以接头衔接器的形式连接在自然杀伤细胞膜表面,具有起效快、抗肿瘤作用强、副作用小、制备时间短、成本可控、易于大规模应用于临床等优势。
王启鸣介绍,Trop2 CAR-NK细胞治疗的临床应用具有广阔的前景,有望为晚期难治性非小细胞肺癌患者提供一种全新的治疗手段。通过这项研究,希望能够为这类患者带来更多的生存机会和生活质量的提升。
该项目已完成前期临床前研发工作,同步开展了国家一类生物药的注册临床研究(IND)申报工作。此次探索性临床研究,将采用单臂、前瞻性、开放性和探索性的设计,计划招募50名晚期难治性非小细胞肺癌患者,以评估联合疗法的临床疗效。
(1)18周岁≤年龄≤79周岁,性别不限;
(2)预计生存时间3个月以上;
(3)ECOG评分为小于或等于1分;
(4)经过影像学检查、组织和/或细胞学检查诊断为IIIB-IV期非小细胞肺癌(根据国际抗癌联盟和美国癌症联合委员会(AJCC)第8版肺癌TNM分期),不适合接受根治性局部治疗;
(5)对于驱动基因(EGFR/ALK/ROS-1/BRAF V600E/MET 14号外显子突变/NTRK)阴性的患者,一线PD-1/PD-L1免疫联合含铂双药化疗治疗后失败;
对于EGFR敏感突变(19del、21L858R、18exonG719X、20exonS768I、21exonL861Q)的患者,须符合下述任一要求:a)经第1代或第2代EGFR-TKI治疗失败,且治疗失败后经组织学证实T790M突变阴性;b)无论T790M突变状态如何,经第3代EGFR-TKI治疗失败;对于除EGFR突变之外的其他驱动基因阳性、且已有获批一线靶向治疗药物的患者,一线靶向治疗失败;除EGFR突变之外的其他驱动基因阳性、且无获批一线靶向治疗药物的患者,一线PD-1/PD-L1免疫联合含铂双药化疗治疗后失败;注:对于非鳞NSCLC受试者,如果EGFR和ALK均为阴性,不需要进行其他驱动基因检测;对于鳞状NSCLC受试者,不强制要求入组前进行驱动基因检测;
(6)根据RECIST1.1版至少有一个可测量的肿瘤病灶;
(7)肿瘤组织样本(既往或新鲜)Trop2蛋白为至少50%弱阳性表达。
(8)具有充分的器官和骨髓功能。
